Laju Reaksi Kimia
- Dapatkan link
- X
- Aplikasi Lainnya
Laju Reaksi : Pengertian, Rumus, Contoh Soal Dan Faktor Yang Mempengaruhi
Laju Reaksi : Pengertian, Faktor Yang Mempengaruhi, Dan Rumus Beserta Contoh Soalnya Lengkap
Konsep pembelajaran kimia merupakan konsep yang erat dengan kehidupan sehari hari. Kimia menggambarkan kehidupan sedemikian rupa sehingga terlihat lebih rinci dan beragam. Hal ini lah yang membuat para pengajar menerapkan konsep kimia ke dalam kehidupan sehari-hari dengan menghadirkannya dalam contoh-contoh sederhana. Selain itu, juga dilakukan pengenalan terhadap konsep-konsep yang sering digunakan dalam dunia luas, bahkan kebiasaan yang sederhana yang sering kita lakukan tanpa kita ketahui itu merupakan konsep kimia.
Salah satu contohnya yaitu pada konsep laju reaksi dalam kimia. Dalam kimia dijelaskan bahwasanya laju reaksi adalah adalah besarnya perubahan jumlah pereaksi dan hasil reaksi per satuan waktu. Perubahan ini dapat dikatakan perubahan konsentrasi molar (molaritas) sehingga laju reaksi dapat dikatakan perubahan konsentrasi akhir (hasil reaksi) terhadap konsentrasi awal (pereaksi) per satuan waktu.
Banyak sekali konsep laju reaksi yang kita temukan dalam kehidupan sehari-hari. Oleh karena itu, dalam makalah ini akan dijelaskan secara rinci manfaat laju reaksi dalam kehidupan sehari-hari.
Pengertian Laju Reaksi
Laju reaksi merupakan laju penurunan reaktan (pereaksi) atau laju bertambahnya produk (hasil reaksi). Laju reaksi ini juga menggambarkan cepat lambatnya suatu reaksi kimia, sedangkan reaksi kimia merupakan proses mengubah suatu zat (pereaksi) menjadi zat baru yang disebut dengan produk.
Beberapa reaksi kimia ada yang berlangsung cepat. Natrium yang dimasukkan ke dalam air akan menunjukkan reaksi hebat dan sangat cepat, begitu pula dengan petasan dan kembang api yang disulut. Bensin akan terbakar lebih cepat daripada minyak tanah. Namun, ada pula reaksi yang berjalan lambat. Proses pengaratan besi, misalnya, membutuhkan waktu sangat lama sehingga laju reaksinya lambat.
Cepat lambatnya proses reaksi kimia yang berlangsung dinyatakan dengan laju reaksi. Dalam mempelajari laju reaksi digunakan besaran konsentrasi tiap satuan waktu yang dinyatakan dengan molaritas. Apakah yang dimaksud molaritas? Simak uraian berikut.
Molaritas sebagai Satuan Konsentrasi dalam Laju Reaksi
Molaritas menyatakan jumlah mol zat dalam 1 L larutan, sehingga molaritas yang dinotasikan dengan M, dan dirumuskan sebagai berikut.
M = n/V
Keterangan :
n = jumlah mol dalam satuan mol atau mmol
V = volume dalam satuan L atau mL
V = volume dalam satuan L atau mL
Manfaat Laju Reaksi
dalam Kehidupan Sehari-Hari
Dengan mempelajari laju reaksi kita dapat mengetahui bahwa reaksi itu dapat berlangsung dipengaruhi oleh beberapa faktor, misalnya saja luas permukaan. Jika kita mengetahui bahwa luas permukaan itu mempengaruhi laju reaksi, pasti kita akan memperkecil luas permukaan suatu zat sebelum mengolahnya.
- Beberapa contoh penerapan Laju Reaksi dalam kehidupan sehari hari :
- Ibu di rumah atau pedagang bubur kacang mengiris terlebih dahulu gula merah yang akan di masukan ke dalam bubur kacang.
- Penduduk pedesaan membelah kayu gelondongan menjadi beberapa bagian sebelum dimasukkan ke dalam tungku perapian.
- Penjual gado-gado, lontong, dan pecel terlebih dulu menggerus kacang goreng sebelum dicampurkan dengan bahan lain.
- Dalam pembuatan kertas, bahan baku pembuat kertas digerus terlebih dahulu untuk membuat bubur kertas. Agar memperluas pemukaan bidang sentuh sehingga campuran menjadi homogen danreaksi berlangsung sempurna.
- Bahan baku yang sering di tambang, tersedia dalam bentuk butir-butiran kasar. Untuk mempercepat pengolahan selanjutnya, butiran-butiran tersebut dihancurkan sampai halus.
- Dalam pembuatan roti kita bisa menambahkan ragi yang berfungsi sebagai katalis untuk mempercepat laju reaksinya.
Faktor Laju Reaksi
Faktor-faktor yang mempengaruhinya antara lain:
1. Konsentrasi Reaktan
Semakin tinggi konsentrasi reaktan, semakin banyak jumlah partikel reaktan yang bertumbukan, sehingga semakin tinggi frekuensi terjadinya tumbukan dan lajunya meningkat. Sebagai contoh, dalam reaksi korosi besi di udara, laju reaksi korosi besi lebih tinggi pada udara yang kelembabannya lebih tinggi (konsentrasi reaktan H2O tinggi)
2. Suhu
Suhu juga turut berperan dalam mempengaruhi laju reaksi. Apabila suhu pada suatu reaksi yang berlangusng dinaikkan, maka menyebabkan partikel semakin aktif bergerak, sehingga tumbukan yang terjadi semakin sering, menyebabkan laju reaksi semakin besar. Sebaliknya, apabila suhu diturunkan, maka partikel semakin tak aktif, sehingga laju reaksi semakin kecil.
3. Tekanan
Banyak reaksi yang melibatkan pereaksi dalam wujud gas. Kelajuan dari pereaksi seperti itu juga dipengaruhi tekanan. Penambahan tekanan dengan memperkecil volume akan memperbesar konsentrasi, dengan demikian dapat memperbesar laju reaksi.
4. Keberadaan Katalis
Katalis adalah suatu zat yang mempercepat laju reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.
5. Luas Permukaan Sentuh
Luas permukaan sentuh memiliki peranan yang sangat penting dalam laju reaksi, sebab semakin besar luas permukaan bidang sentuh antar partikel, maka tumbukan yang terjadi semakin banyak, sehingga menyebabkan laju reaksi semakin cepat.
Begitu juga, apabila semakin kecil luas permukaan bidang sentuh, maka semakin kecil tumbukan yang terjadi antar partikel, sehingga laju reaksi pun semakin kecil. Karakteristik kepingan yang direaksikan juga turut berpengaruh, yaitu semakin halus kepingan itu, maka semakin cepat waktu yang dibutuhkan untuk bereaksi; sedangkan semakin kasar kepingan itu, maka semakin lama waktu yang dibutuhkan untuk bereaksi.
Rumus Laju Reaksi
Laju reaksi kimia bukan hanya sebuah teori, namun dapat dirumuskan secara matematis untuk memudahkan pembelajaran. Pada reaksi kimia: A → B, maka laju berubahnya zat A menjadi zat B ditentukan dari jumlah zat A yang bereaksi atau jumlah zat B yang terbentuk per satuan waktu. Pada saat pereaksi (A) berkurang, hasil reaksi (B) akan bertambah. Perhatikan diagram perubahan konsentrasi pereaksi dan hasil reaksi pada Gambar 3.
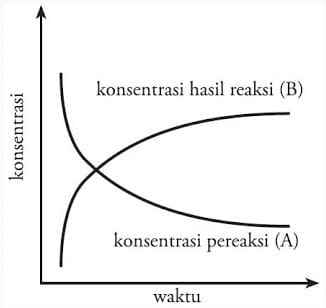
Berdasarkan gambar tersebut, maka rumusan laju reaksi dapat kita definisikan sebagai:
a. berkurangnya jumlah pereaksi (konsentrasi pereaksi) per satuan waktu, atau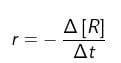 , dengan r = laju reaksi, – d[R] = berkurangnya reaktan (pereaksi), dan dt = perubahan waktu. Untuk reaksi : A → B, laju berkurangnya zat A adalah :
, dengan r = laju reaksi, – d[R] = berkurangnya reaktan (pereaksi), dan dt = perubahan waktu. Untuk reaksi : A → B, laju berkurangnya zat A adalah : 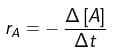
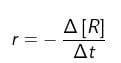 , dengan r = laju reaksi, – d[R] = berkurangnya reaktan (pereaksi), dan dt = perubahan waktu. Untuk reaksi : A → B, laju berkurangnya zat A adalah :
, dengan r = laju reaksi, – d[R] = berkurangnya reaktan (pereaksi), dan dt = perubahan waktu. Untuk reaksi : A → B, laju berkurangnya zat A adalah :
b. bertambahnya jumlah produk (konsentrasi produk) per satuan waktu, atau 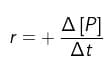 , dengan +Δ[P] = bertambahnya konsentrasi produk (hasil reaksi). Untuk reaksi : A → B, laju bertambahnya zat B adalah :
, dengan +Δ[P] = bertambahnya konsentrasi produk (hasil reaksi). Untuk reaksi : A → B, laju bertambahnya zat B adalah : 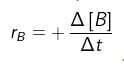
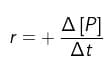 , dengan +Δ[P] = bertambahnya konsentrasi produk (hasil reaksi). Untuk reaksi : A → B, laju bertambahnya zat B adalah :
, dengan +Δ[P] = bertambahnya konsentrasi produk (hasil reaksi). Untuk reaksi : A → B, laju bertambahnya zat B adalah : 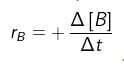
Bagaimana untuk reaksi yang lebih kompleks, semisal : pA + qB → rC.
Untuk reaksi demikian, maka :
Dalam perbandingan tersebut, tanda + atau – tidak perlu dituliskan karena hanya menunjukkan sifat perubahan konsentrasi. Oleh karena harga dt masing-masing sama, maka perbandingan laju reaksi sesuai dengan perbandingan konsentrasi. Di sisi lain, konsentrasi berbanding lurus dengan mol serta berbanding lurus pula dengan koefisien reaksi, sehingga perbandingan laju reaksi sesuai dengan perbandingan koefisien reaksi. Perbandingan tersebut dapat dituliskan sebagai berikut.
rA : rB : rC = p : q : r
JURNAL PERCOBAAN LAJU REAKSI DAN PEMBAHASAN
ALAT DAN BAHAN
> ALAT
| 1. | tabung reaksi | (6 buah) |
| 2. | rak tabung reaksi | (1 buah) |
| 3. | stopwatch | (1 buah) |
| 4. | kertas hvs | (1 lembar) |
| 5. | gelas beaker 100ml | (2 buah) |
| 6. | water bath | (1 buah) |
| 7. | thermometer | (1 buah) |
| 8. | pipet tetes | (2 buah) |
| 9. | neracaohaus | (1 buah) |
| 10. | gelas ukur | (1 buah) |
| 11. | alu dan mortar | (1 buah) |
| 12. | spatula | (1 buah) |
| 13. | cawan petri | (1 buah) |
| 14. | penjepit kayu | (1 buah) |
| 15. | spidol | (1 buah) |
| BAHAN | ||
| 1. | pita magnesium | (4 pcs Masing-masing 0,5 cm) |
| 2. | HCl 0,1M | (15 ml) |
| 3. | HCl 0,5M | (1 ml) |
| 4. | HCl 1M | (1ml) |
| 5. | HCl 2M | (1ml) |
| 6. | HCl 3M | (1ml) |
| 7. | Na2S2O3 | (15 ml) |
| 8. | NaCl 0,1M | (4 tetes) |
| 9. | FeCl3 0,1M | (4 tetes) |
| 10. | H2O2 | (15 ml) |
| 11. | Marmer Serbuk | (1 gram) |
| 12. | Marmer Bongkahan | (1 gram) |
- METODE KERJA
Percobaan 1
|
Percobaan 2
|
| 4 | masukan thermometer
kedalam gelas beaker untu mengukur suhu awal
Na2S2O3
| suhu 29oc |
| 5 | dituangkan HCl 0,1M
kedalam gelas ukur
sebanyak 15 ml
| tidak terjadi reaksi |
| 6 | Dituangkan HCl kedalam gelas beaker berisi
Na2S2O3 0,1M yang berada di atas kertas yang telah ditandai
| Terjadi perubahan warna yaitu berwarna putih susu dan larutan berbau |
| 7 | panaskan Na2S2O3 dan HCl masing-masing 15 ml
didalam water bath sampai suhu (60,50,40)oc
| Larutan menjadi panas karena suhu meningkat setelah dipanaskan |
| 8 | dituangkan HCl dan
Na2S2O3 secara bersamaan kedalam gelas beaker diatas kertas yang telah ditandai
| Larutan menjadi berwarna putih susu sampai tanda X tidak tampak. Pada suhu:
60oC= 52s 50oC = 107s 40oC = 122s
|
1. Perhatikan contoh reaksi sebagai berikut :
2 N2O5 → 4 NO2 + O2
Buatlah sebuah rumus persamaan laju reaksi pada masing-masing reaksi senyawa tersebut!
Rumus dalam mencari laju reaksi yaitu:
2. Perhatikan pada reaksi berikut ini!
tabel reaksi
tabel reaksi
Buatlah persamaan laju reaksi diatas!
bandingkan orde SO2 dengan O2
bandingkan orde SO2 dengan O2
bandingkan O2 dengan SO2
bandingkan O2 dengan SO2
Hasil dari persamaan laju reaksi adalah :
Demikian pembahasan tentang pengertian laju reaksi, faktor yang mempengaruhi laju reaksi, persamaan laju reaksi dan rumus-rumusnya, kemudian soal laju reaksi. Semoga bermanfaat🙂
- Dapatkan link
- X
- Aplikasi Lainnya

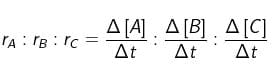






Komentar
Posting Komentar